สารในชีวิตประจำวันเช่นแก๊สออกซิเจนและแก๊สคาร์บอนไดออกไซด์ที่เกี่ยวข้องกับกระบวนการหายใจของสิ่งมีชีวิตน้ำเป็นของเหลวที่ใช้ในการอุปโภคและบริโภคเกลือแกงเป็นของแข็งที่ใช้ในการประกอบอาหารสารเหล่านี้ส่วนใหญ่ไม่อยู่ในรูปอะตอมเดี่ยวแต่ประกอบด้วยหลายอะตอมซึ่งอาจเป็นอะตอมชนิดเดียวกันหรือต่างชนิดกันการยึดเหนี่ยวกันของอะตอมหรือไอออนในสารเรียกว่าพันธะเคมี 3.1 ลักษณะแบบจุดของลิวอิสและกฎออกเตต
จากการศึกษาเรื่องอะตอมและสมบัติของธาตุทำให้ทราบว่าเวเลนซ์อิเล็กตรอนเป็นอิเล็กตรอนที่อยู่ในระดับพลังงานสูงสุดหรือชั้นนอกสุดของอะตอมธาตุคาร์บอนมีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อยเป็น 1s^2 2s^2 2p^2 ดังนั้น คาร์บอนมีเวเลนซ์อิเล็กตรอนเท่ากับ 4 ทั้งนี้การเกิดพันธะเคมีเกี่ยวข้องกับเวเลนซ์อิเล็กตรอนของอะตอมที่ร่วมสร้างพันธะกัน
เวเลนซ์อิเล็กตรอนของธาตุอาจแสดงด้วยจุดสัญลักษณ์ที่แสดงธาตุและเวเลนซ์อิเล็กตรอนของธาตุเรียกว่า สัญลักษณ์แบบจุดของลิวอิสซึ่งเสนอโดย กิลเบิร์ต นิวตัน ลิวอิส สัญลักษณ์แบบจุดของลิวอิสใช้จุดแสดงจำนวนเวเลนซ์อิเล็กตรอนรอบสัญลักษณ์ของธาตุดังรูป

ธาตุต่างๆส่วนใหญ่ไม่เสถียรในรูปอะตอมเดี่ยวยกเว้นเพื่อนในหมู่ 18 หรือเรียกว่าแก๊สมีสกุลที่ผมอยู่ในรูปอะตอมเดี่ยวซึ่งมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากับ 8 ยกเว้นฮีเลียมซึ่งมี 2 เวเลนซ์อิเล็กตรอนนอกจากนี้นักเคมี ยังพบว่าอะตอมของธาตุอื่นๆมีแนวโน้มที่จะรวมตัวกัน เพื่อที่จะทำให้แต่ละอะตอมมีเวเลนซ์อิเล็กตรอนเท่ากับ 8 จึงมีการสรุปเป็นหลักการที่เกี่ยวกับกฎออกเตต ศาลที่ไม่อยู่ในรูปอะตอมเดี่ยวมีพันธะเคมีระหว่างอะตอมหรือไอออนโดยที่อะตอมของธาตุจะมีการให้อิเล็กตรอนรับอิเล็กตรอนหรือใช้อิเล็กตรอนร่วมกันทำให้เกิดพันธะเคมีสารประเภทได้แก่พันธะไอออนิกพันธะโคเวเลนต์และพันธะโลหะ 3.2 พันธะไอออนิก
สารที่เกิดจากธาตุโลหะกับธาตุอโลหะ มีสมบัติบางประการทางการและสารเหล่านี้มีการยึดเหนี่ยวระหว่างอนุภาคที่เหมือนกัน
3.2.1 การเกิดพันธะไอออนิก
ธาตุโลหะมีพลังงานไอออไนเซชันต่ำจึงเสียอิเล็กตรอนเกิดเป็นไอออนบวกได้ง่ายส่วนธาตุอโลหะมีค่าสัมพรรคภาพอิเล็กตรอนสูง จึงรับอิเล็กตรอนเกิดเป็นไอออนลบ ไอออนบวกและไอออนลบมีประจุไฟฟ้าต่างกันจึงยึดเหนี่ยวกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้าเรียกการยึดเหนี่ยวนี้ว่าพันธะไอออนิกและสารที่เกิดขึ้นจากพันธะไอออนิกว่าสารประกอบไอออนิกชื่อสารประกอบไอออนิกที่เกิดขึ้นส่วนใหญ่เป็นไปตามกฎออกเตตดังตัวอย่าง

สารประกอบไอออนิกในสถานะของแข็งอยู่ในรูปของผลึกที่มีไอออนบวกและไอออนลบยึดเหนี่ยวกันด้วยพันธะไอออนิกอย่างต่อเนื่องกันไปทั้ง 3 มิติเป็นโครงผลึก และไม่อยู่ในรูปโมเลกุล
3.2.2 สูตรเคมีและชื่อของสารประกอบไอออนิก สารประกอบไอออนิกประกอบด้วยไอออนบวกและไอออนลบที่มีประจุต่างกัน ซึ่งมีผลต่ออัตราส่วนการรวมของไอออนและสูตรของสารประกอบไอออนิกด้วยประจุของไอออน 5 มูลหลักเป็นบวกตามจำนวนและการที่ให้หรือเป็นโรคตามจำนวนอิเล็กตรอนที่รับเพื่อทำให้มีการจัดเรียงอิเล็กตรอนของไอออนเป็นไปตามกฎออกเตต
จากตาราง 3.1 ถ้าโซเดียมซึ่งเป็นธาตุหมู่ IA เมื่อเกิดเป็นไอออนบวกจะมีประจุเป็นบวก 1 5 แคลเซียมซึ่งเป็นธาตุหมู่ iia เมื่อเกิดเป็นไอออนบวกจะมีประจุเป็นบวก 2 และธาตุอะลูมิเนียมซึ่งเป็นธาตุหมู่ IIIA เมื่อเกิดเป็นไอออนบวกจะมีประจุเป็นบวก 3 ดังนั้นธาตุหมู่ IA IA และ IIA เมื่อเป็นไอออนจะเป็นไอออนที่มีประจุตามเลขหมู่ 5 กรณีซึ่งเป็นธาตุหมู่ VIIA เมื่อเกิดเป็นไอออนลบจะมีประจุเป็น -1 ให้ออกซิเจนซึ่งเป็นธาตุหมู่ VIIA เมื่อเกิดเป็นไอออนลบจะมีประจุเป็น -2 และธาตุไนโตรเจนซึ่งเป็นธาตุหมู่ VA เมื่อเกิดเป็นไอออนลบจะมีประจุเป็น -3 ดังนั้นธาตุหมู่ VA VIA และ VIIA เมื่อเป็นไอออน จะเป็นไอออนลบที่มีประจุ X-8 เมื่อ X คือเลขหมู่ของธาตุอโลหะ
การที่โครงสร้างของสารประกอบไอออนิกที่มีไอออนบวกและไอออนลบยึดเหนี่ยวกันอย่างต่อเนื่องกันไปทั้ง 3 มิติเป็นโครงผลึกไม่สามารถแยกเป็นโมเลกุลได้ดังนั้นจึงใช้สูตรเอมพิริคัล แสดงอัตราส่วนอย่างต่ำของจำนวนไอออนที่เป็นองค์ประกอบซึ่งทำให้ได้ผลรวมประจุเป็นศูนย์
การเขียนสูตรสารประกอบไอออนิกจะเขียนสัญลักษณ์ของธาตุที่เป็นไอออนบวกไว้ข้างหน้าตามด้วยไอออนลบและแสดงอัตราส่วนอย่างต่ำของไอออนที่เป็นองค์ประกอบโดยเขียนตัวเลขอารบิกให้ทายไอออนทั้งนี้กรณีที่จำนวนไอออนเป็นหนึ่งไม่ต้องเขียนเช่นสารประกอบไอออนิกที่เกิดจากแคลเซียมไอออนกับฟลูออไรด์ไอออนมีอัตราส่วนประจุของ Ca^2+ ต่อ F^- เป็น 2 ต่อ 1 ซึ่งเมื่อทำให้ผลรวมของประจุเป็นศูนย์จะได้อัตราส่วนอย่างต่ำของจำนวน Ca^2+ ต่อ F^- เป็น 1:2 ดังนั้นสูตรสารประกอบเป็น CaF^2
ไอออนบางชนิดเกิดจากกลุ่มอะตอมการเขียนสูตรสารประกอบจะใช้หลักการเดียวกับไอออนบวกและไอออนลบที่เกิดจากธาตุ เช่นสูตรสารประกอบไอออนิกที่เกิดจากมีไอออนกับซัลเฟตไอออนมีอัตราส่วนประจุของ NH^4+ ต่อ SO4^2- เป็น 1 ต่อ 2 ซึ่งเมื่อทำให้ผลรวมของประจุเป็นศูนย์ จะได้อัตราส่วนอย่างต่ำของจำนวน NH^4+ ต่อ SO4^2- เป็น 2:1 ดังนั้นสูตรสารประกอบเป็น (NH4)2SO4
สารประกอบไอออนิกเกิดจากไอออนบวกและไอออนลบดังนั้นการเรียกชื่อสารประกอบไอออนิกจึงจำเป็นต้องสร้างชื่อของไอออนบวกและไอออนลบโดยชื่อของไอออนบวกเรียกตามชื่อถ้าเราลงท้ายด้วยคำว่าไอออนส่วนไอออนลบเรียกตามชื่อธาตุโดยเปลี่ยนท้ายเสียงเป็น i-de
จากตารางจะเห็นว่าชื่อไอออนลบของธาตุไฮโดรเจนออกซิเจนและไนโตรเจนมีการตัดคำว่าเช่นออกก่อนจะเปลี่ยนท้ายเป็นเสียง i-de ไอออนที่เป็นกลุ่มอะตอมมีชื่อเรียกเฉพาะโดยกลุ่มอะตอมที่เป็นไอออนบวกลงท้ายด้วย -ium ส่วนกลุ่มอะตอมที่เป็นไอออนลบอาจจะลงท้ายด้วยเสียง -ide -ite -ate
ชื่อสารประกอบไอออนิกได้จากการเรียกชื่อไอออนบวกแล้วตามด้วยชื่อไอออนลบโดยตัดคำว่าไอออนออก ดังตาราง
ชื่อสารประกอบที่เกิดจากโลหะที่มีเลขออกซิเดชันมากกว่า 1 ค่า ต้องระบุตัวเลขประจุหรือเลข ออกซิเดชันของไอออนนั้นเป็นเลขโรมันในวงเล็บดังตาราง
3.2.3 พลังงานกับการเกิดสารประกอบไอออนิก
ปฏิกิริยาเคมีนอกจากจะเกี่ยวข้องกับการเปลี่ยนแปลงของสารเคมีแล้วส่วนใหญ่ยังเกี่ยวข้องกับการเปลี่ยนแปลงพลังงานอีกด้วยซึ่ง พลังงานการเกิดของสารประกอบ สามารถหาได้จากการทดลองในการทำปฏิกิริยาระหว่างธาตุ เช่นการเกิดสารประกอบโซเดียมคลอไรด์จากโลหะโซเดียมทำปฏิกิริยากับแก๊สคลอรีนเกิดเป็นโซเดียมคลอไรด์มีการคายพลังงาน 412 กิโลจูลต่อโมล
Na(s) + 1/2Cl2(g) ---> NaCl(s) -412kJ/mol
ปฏิกิริยาเคมีเกี่ยวข้องกับการสลายพันธะและการสร้างพันธะ ซึ่งการสลายพันธะ เป็นกระบวนการดูดพลังงาน ในขณะที่การสร้างพันธะเป็นกระบวนการคายพลังงานดังนั้นปฏิกิริยาที่เกิดขึ้นจากการรวมตัวกันของไอออนบวกและไอออนลบเกิดเป็นสารประกอบไอออนิกเป็นปฏิกิริยาคายพลังงานเนื่องจากมีการสร้างพันธะไอออนิก
พลังงานที่เกี่ยวข้องกับการรวมตัวกันของไอออนบวกและไอออนลบในสารประกอบไอออนิกเรียกว่าพลังงานโครงผลึกซึ่งในทางปฏิบัติไม่สามารถทำการทดลองได้โดยนำไอออนบวกและไอออนลบที่บริสุทธิ์มาทำปฏิกิริยากันได้ค่าพลังงานดังกล่าวจึงได้จากการคำนวณโดยอาศัยขั้นตอนการเกิดปฏิกิริยาย่อยๆหลายขั้นตอนตามวัฏจักรบอร์น-ฮาเบอร์ โดยมีสมมติฐานว่าพลังงานรวมในแต่ละขั้นตอนจะเท่ากับพลังงานในการเกิดสารประกอบไอออนิกเช่นการเกิดสารประกอบโซเดียมคลอไรด์ 1 โมล ประกอบด้วยขั้นตอนต่างๆดังนี้
1.โลหะโซเดียมสถานะของแข็งระเหิดกลายเป็นแก๊ส ดูดพลังงาน 107 กิโลจูลต่อโมล เรียกพลังงานที่ใช้ในขั้นนี้ว่าพลังงานการระเหิด
Na(s) ---> Na(g) 107kJ/mol
2.อะตอมของโซเดียมในสถานะแก๊สเสียอิเล็กตรอนกลายเป็น Na^+ ดูดพลังงาน 496 กิโลจูลต่อโมล เรียกพลังงานที่ใช้ในขั้นนี้ว่า พลังงานไอออไนเซชัน
Na(g) ---> Na^+(g) + e^- 496kJ/mol
3.โมเลกุลแก๊สคลอรีนสลายพันธะ Cl-Cl ได้อะตอมคลอรีน 2 อะตอมในสถานะแก๊ส ดูดพลังงานเท่ากับ 242 กิโลจูลต่อโมล เรียกพลังงานที่ใช้ในขั้นนี้ว่า พลังงานพันธะ
Cl2(g) ---> 2Cl(g) 242kJ/mol
แต่เนื่องจาก NaCl 1 โมลประกอบด้วย Cl^- 1โมลไอออน ดังนั้นพลังงานที่ใช้ในขั้นนี้จะเป็นครึ่งหนึ่งของพลังงานการสลายพันธะต่อโมลของ Cl2 นั่นคือจะใช้พลังงานเพียง 121 กิลโลจูล
1/2Cl2(g) ---> Cl(g) 121kJ
4.อะตอมคลอรีนในสถานะแก๊สเมื่อรับอิเล็กตรอนที่หลุดออกจากอะตอมโซเดียมแล้วกลายเป็น Cl^- จะคายพลังงาน 349 กิโลจูลต่อโมล พลังงานที่ได้ในขั้นนี้เรียกว่า สัมพรรคภาพอิเล็กตรอน
Cl(g) + e^- ---> Cl^-(g) -349kJ/mol
5.เมื่อโซเดียมไอออนกับคลอไรด์ไอออนในสถานะแก๊สกันเป็นผลึกโซเดียมคลอไรด์จะคายพลังงานออกมาพลังงานที่ได้ในครั้งนี้เรียกว่า พลังงานของผลึก หรือ พลังงานแลตทิซ
Na^+ + Cl^- (g) ---> NaCl(s) พลังงานโครงผลึก
เมื่อรวมสมการของปฏิกิริยาย่อยทั้ง 5 ขั้นจะเหลือ Na และ Cl2 เป็นสารตั้งต้น และเหลือ NaCl เป็นผลิตภัณฑ์โดยสารอื่นๆและอิเล็กตรอนจะหักล้างกันหมดดังนี้
ซึ่งปฏิกิริยารวมที่ได้เหมือนกับปฏิกิริยาการเกิดสารประกอบโซเดียมคลอไรด์ดังสมการ
Na(s) +1/2Cl2(g) ---> NaCl(s)
และมีค่าพลังงานรวม = 107 + 496 + 121 + (-349) + พลังงานแลตทิซ
เนื่องจากพลังงานการเกิดสารประกอบโซเดียมคลอไรด์ซึ่งสามารถหาได้จากการทดลองมีค่าเป็น -412 kJ/mol ดังนั้นสามารถคำนวณหาค่าพลังงานแลตทิซดังนี้
-412 = 107 + 496 + 121 + (-349) + พลังงานแลตทิซ
พลังงานแลตทิซ = -787kJ/mol
ค่าพลังงานแลตทิซที่คำนวณได้มีค่าเป็นลบแสดงว่าการรวมตัวกันของโซเดียมไอออนและคลอไรด์ไอออนทำให้เกิดการคายพลังงานในทางตรงกันข้ามการสลายพันธะระหว่างโซเดียมไอออนและคลอไรด์ไอออนในโครงผลึกของโซเดียมคลอไรด์จะเป็นกระบวนการดูดพลังงานซึ่งจะมีเครื่องหมายและค่าพลังงานเป็นบวก
วัฏจักรบอร์นฮาเบอร์ ของการเกิดสารประกอบโซเดียมคลอไรด์แอนด์เขียนเป็นแผนภาพเพื่อแสดงการเปลี่ยนแปลงพลังงานได้ดังรูป
จากรูปจะสังเกตเห็นได้ว่าพลังงานที่ได้จากขั้นตอนการพลังงานมีค่ามากกว่าพลังงานที่ได้จากขั้นตอนดูดพลังงานจึงทำให้เกิดสารประกอบโซเดียมคลอไรด์เป็นปฏิกิริยาคายพลังงาน
3.2.4 สมบัติของสารประกอบไอออนิก
สารประกอบไอออนิกส่วนใหญ่เป็นผลึกที่แข็งเนื่องจากการยึดเหนี่ยวที่แข็งแรงระหว่างไอออนบวกและไอออนลบและผลึกของสารประกอบไอออนิกมีความเปราะ แตกหักได้ง่ายเนื่องจากการเลื่อนตำแหน่งเพียงเล็กน้อยของไอออนเมื่อมีแรงกระทำอาจทำให้ไอออนชนิดเดียวกันลื่นไถลไปอยู่ตำแหน่งตรงกลางจึงเกิดแรงผลักระหว่างกันดังรูป
จากรูปจะสังเกตเห็นได้ว่าพลังงานที่ได้จากขั้นตอนการพลังงานมีค่ามากกว่าพลังงานที่ได้จากขั้นตอนดูดพลังงานจึงทำให้เกิดสารประกอบโซเดียมคลอไรด์เป็นปฏิกิริยาคายพลังงาน
สารประกอบไอออนิกสถานะของแข็งไม่นำไฟฟ้าเนื่องจาก ไอออนที่เป็นองค์ประกอบยึดเหนี่ยวกันอย่างแข็งแรงไม่สามารถเคลื่อนที่ได้แต่เมื่อหลอมเหลวหรือละลายน้ำจะนำไฟฟ้าได้ดีเนื่องจากไอออนที่เป็นองค์ประกอบยึดเหนี่ยวกันอย่างแข็งแรงไม่สามารถเคลื่อนที่ได้ แต่เมื่อหลอมเหลวหรือละลายน้ำจะนำไฟฟ้าได้เนื่องจากไอออนสามารถเคลื่อนที่ได้ สารประกอบไอออนิกมีจุดหลอมเหลวและจุดเดือดสูงส่วนใหญ่ละลายน้ำได้และสารละลายของสารประกอบไอออนิกในน้ำส่วนใหญ่มีสมบัติเป็นเบสหรือกลางโดยสารละลายของสารประกอบออกไซด์มีสมบัติเป็นเบสและสารละลายของสารประกอบคลอไรด์มีสมบัติเป็นกลาง ดังตาราง
การละลายน้ำของสารประกอบไอออนิกเกี่ยวข้องกับกระบวนการที่ไอออนบวกและไอออนลบแยกออกจากโครงผลึกและเป็นกระบวนการที่โมเลกุลของน้ำล้อมรอบไอออนแต่ละชนิดโดยสารที่เมื่อละลายน้ำแล้วแตกตัวเป็นไอออนเรียกสามีว่าสารละลายอิเล็กโทรไลต์
กระบวนการที่ไอออนบวกและไอออนลบแยกออกจากโครงผลึกเป็นกระบวนการดูดพลังงานที่มีค่าเท่ากับพลังงานและแลตทิซ ดังที่ได้กล่าวมาแล้ว ส่วนกระบวนการที่โมเลกุลของน้ำล้อมรอบไอออนแต่ละชนิดเป็นกระบวนการคายพลังงานที่เรียกว่า พลังงานไฮเดรชัน
ถ้าค่าพลังงานแลตทิซ น้อยกว่าค่าพลังงานไฮเดรชันการละลายจะเป็นกระบวนการคายพลังงานซึ่งจะทำให้อุณหภูมิของสารละลายสูงขึ้นและสารละลายจะละลายได้ดีที่อุณหภูมิต่ำในทางกลับกันถ้าค่าพลังงานแลตทิซมากกว่าค่าพลังงานไฮเดรชันการละลายจะเป็นกระบวนการดูดพลังงานซึ่งจะทำให้อุณหภูมิของสารละลายลดลงและสารจะละลายได้ดีที่อุณหภูมิสูงในกรณีที่มีค่าพลังงานแลตทิซมากกว่าพลังงานไฮเดรชันมากๆ สารอาจจะละลายได้น้อยมากหรือไม่ละลาย
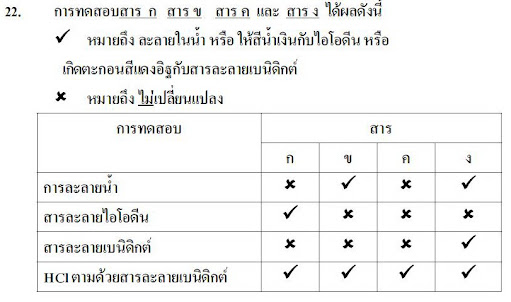
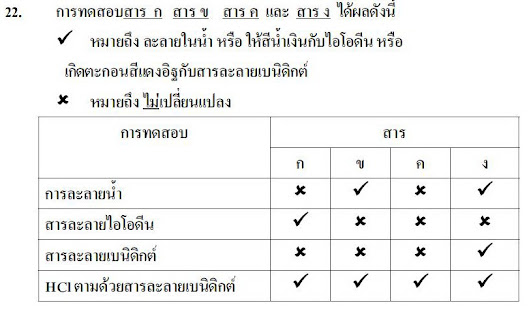
จากที่ทราบแล้วว่าสารประกอบไอออนิกเมื่อละลายน้ำไอออนบวกและไอออนลบจะแยกออกจากกันถ้าการผสมสารละลายของสารประกอบไอออนิกทำให้เกิดตะกอนแสดงว่าไอออนในสารละลายผสมทำปฏิกิริยากันเกิดเป็นสารใหม่ที่ไม่ละลายน้ำ ดังรูป
ปฏิกิริยาการเกิดตะกอนของสารประกอบไอออนิกในน้ำอาจเขียนแทนด้วยสมการไอออนิก ที่แสดงไอออนในสารละลายครบทุกชนิดเช่นปฏิกิริยาระหว่างสารละลายซิลเวอร์ไนเตรตกับสารละลายโซเดียมคลอไรด์เขียนสมการไอออนิกได้ดังนี้
Ag^+(aq) + NO3^-(aq) + Na^+(aq) + Cl^-(aq) ---> AgCl(s) + NO3^-(aq) + Na^+(aq)
ไอออนในสมการของปฏิกิริยาที่มีน้ำเป็นตัวทำละลายแสดงสถานะไอออนเป็น aq ซึ่งมาจากคำว่า a queous solution เนื่องจากในสมการไอออนิกมีไอออนที่ไม่ทำปฏิกิริยาการปรากฏอยู่ทางด้านซ้ายและด้านขวาของสมการที่สามารถตัดออกจากสมการให้เหลือเฉพาะไอออนที่ทำปฏิกิริยากันได้เป็นผลิตภัณฑ์เรียกว่า สมการไอออนสุทธิ
Ag^+(aq) + Cl^-(aq) ---> AgCl(s)
การอธิบายหรือการทำนายปฏิกิริยาการเกิดตะกอนของสารละลายของสารประกอบไอออนิก สามารถพิจารณาได้จากสมบัติการละลายน้ำตามหลักการเบื้องต้นดังนี้
สารประกอบที่ละลายน้ำ
-สารประกอบของโลหะแอลคาไลและแอมโมเนียทุกชนิด
-สารประกอบไนเทรต คลอเรต เปอร์คลอเรต แอซีเตต
-สารประกอบคลอไรด์ โบรไมด์ ไอโอไดด์
-สารประกอบคอร์บอเนต ฟอสเฟต ซัลไฟด์ และซัลไฟต์
-สารประกอบซัลเฟต
สารประกอบที่ไม่ละลายน้ำ
-สารประกอบออกไซด์ของโลหะ
-สารประกอบไฮดรอกไซด์
3.3 พันธะโคเวเลนต์
สารที่เกิดจากธาตุอโลหะรวมตัวกันเช่นแก๊สออกซิเจนแก๊สไนโตรเจนและแก๊สคาร์บอนไดออกไซด์ การยึดเหนี่ยวระหว่างอะตอมของธาตุในสารเหล่านี้เป็นพันธะไอออนิกหรือไม่เพราะเหตุใด
3.3.1 การเกิดพันธะโคเวเลนต์
ธาตุอโลหะมีค่าอิเล็กโทรเนกาติวิตีสูงดังนั้นเมื่อรวมตัวกันจะไม่มีอะตอมใดยอมเสียอิเล็กตรอน อะตอมจึงยึดเหนี่ยวกันโดยใช้เวเลนซ์เล็กตรอนร่วมกันเรียกการยึดเหนี่ยวในว่าพันธะโคเวเลนต์แล้วนะสารที่อะตอมยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ว่าสารโคเวเลนต์ซึ่งส่วนใหญ่อยู่ในรูปโมเลกุลโดยการเกิดพันธะในโมเลกุลโคเวเลนต์ส่วนใหญ่เป็นไปตามกฎออกเตตดังตัวอย่าง
คลอรีนมีเวเลนซ์อิเล็กตรอนเท่ากับ 7 ดังนั้นข้อดีทั้ง 2 อะตอมจะใช้เวลาดิจิตอลร่วมกัน 1 คู่เพื่อให้มีเวเลนซ์อิเล็กตรอนครบ 8 ตามกฎออกเตต เขียนแผนภาพและสัญลักษณ์แบบจุดของลิวอิสแสดงการเกิดพันธะได้ดังนี้
พันธะโคเวเลนต์ในโมเลกุลแก๊สคลอรีนเกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 1 คู่พันธะนี้เรียกว่าพันธะเดี่ยว ด้วยอิเล็กตรอนคู่ที่ใช้ร่วมกันในการเกิดพันธะเรียกว่าอิเล็กตรอนคู่ร่วมพันธะส่วนอิเล็กตรอนคู่ที่ไม่ได้เกิดพันธะเรียกว่าอิเล็กตรอนคู่โดดเดี่ยวซึ่งในโมเลกุลแก๊สคลอรีนมีอิเล็กตรอนคู่ร่วมพันธะ 1 คู่และมีอิเล็กตรอนคู่โดดเดี่ยว 6 คู่
อีกทั้งยังมีการเกิดพันธะในโมเลกุล ออกซิเจนแต่ละอะตอมมีเวเลนซ์อิเล็กตรอนเท่ากับ 6 ดังนั้นออกซิเจนทั้ง 2 อะตอมจะใช้เวทีเล็กตอนร่วมกัน 2 คู่เพื่อให้เป็นไปตามกฎออกเตต เกิดพันธะโคเวเลนต์แบบพันธะคู่ นอกจากนี้พันธะโคเวเลนต์ยังอาจเป็นพันธะสาม เช่นในโมเลกุลแก๊สไนโตรเจนไนโตรเจนแต่ละอะตอมมีเวเลนซ์อิเล็กตรอนเท่ากับ 5 ดังนั้นไนโตรเจนทั้ง 2 อะตอมจะใช้เวลาที่เล็กตอนร่วมกัน 3 คู่เพื่อให้เป็นไปตามกฎออกเตต
ในโครงสร้างลิวอิส อิเล็กตรอนคู่ร่วมพันธะสามารถแสดงได้ด้วยเส้นพันธะในขณะที่อิเล็กตรอนคู่โดดเดี่ยวแสดงด้วยจุดคู่เสมอเช่นโมเลกุลแอมโมเนียมีเส้นพันธะ N-H 3 พันธะ แทนอิเล็กตรอนคู่ร่วมพันธะ 3 คู่ ในขณะที่อีเล็คตรอนคู่โดดเดี่ยว 1 คู่แสดงด้วยจุดคู่บนอะตอมไนโตรเจนอิเล็กตรอนคู่โดดเดี่ยวนี้สามารถสร้างพันธะกับ H^+ เกิดเป็นแอมโมเนียมไอออน จำนวนอิเล็กตรอนรอบอะตอมกลางยังคงเป็นไปตามกฎออกเตต ในกรณีที่พันธะโคเวเลนต์ที่เกิดขึ้นมาจากอะตอมไนโตรเจนเท่ากัน แสดงดังนี้
สารโคเวเลนต์บางชนิดอาจมีอะตอมกลางที่มีจำนวนอิเล็กตรอนล้อมรอบไม่เป็นไปตามกฎออกเตต
3.3.2 สูตรโมเลกุลและชื่อของสารโคเวเลนต์
สูตรโมเลกุลของสารโคเวเลนต์โดยทั่วไปเขียนสัญลักษณ์ของธาตุองค์ประกอบโดยเรียงลำดับจากค่าอิเล็กโทรเนกาติวิตีน้อยไปมากพร้อมทั้งระบุจำนวนอะตอมของธาตุที่มีจำนวนอะตอมมากกว่า 1 อะตอมยกเว้นสามารถชนิดเช่น NH3 และ CH4 ทั้งที่ถ้าไนโตรเจนและธาตุคาร์บอนมีอิเล็กโทรเนกาติวิตีสูงกว่าธาตุไฮโดรเจน
การเรียกชื่อสารโคเวเลนต์มีหลักการดังนี้
1.สารโคเวเลนต์ที่ประกอบด้วยธาตุชนิดเดียวกันเรียกตามชื่อท่านนั้นซึ่งท่านเหล่านี้ส่วนใหญ่มีสถานะเป็นแก๊สที่อุณหภูมิห้องจึงนิยมเรียกชื่อโดยระบุสถานะด้วยเพื่อให้ทราบว่าเป็นการกล่าวถึงโมเลกุลที่ไม่ใช่อะตอมของธาตุเช่นแก๊สออกซิเจน
2.สารโคเวเลนต์ที่ประกอบด้วยธาตุ 2 ชนิดให้เรียกชื่อธาตุตามลำดับที่ปรากฏในสูตรโมเลกุลโดยเปลี่ยนพยางค์ท้ายเป็น -ide และระบุจำนวนอะตอมองค์ประกอบ ในโมเลกุลด้วยคำภาษากรีก ดังตาราง
ยกเว้นกรณีที่ธาตุและมีเพียงอะตอมเดียวไม่ต้องระบุจำนวนอะตอมของธาตุนั้น
การเรียกชื่อสารโคเวเลนต์ที่เป็นสารประกอบออกไซด์นอกจากเรียกชื่อสารตามหลักการข้างต้นแล้วยังนิยมเรียกชื่อสารโดยแต่ละตัวสุดท้ายของคำที่ระบุจำนวนอะตอมออก เช่น CO นิยมเรียกว่าคาร์บอนมอนอกไซด์ นอกจากนี้สารบางชนิดยังมีเพียงชื่อเล่นโดยไม่เป็นไปตามหลักการข้างต้นครบทุกประการเช่น HCl นิยมเรียกว่าไฮโดรเจนคลอไรด์ แทนที่จะเรียกว่าไฮโดรเจนมอนอคลอไรด์
3.3.3 ความยาวพันธะและพลังงานพันธะของสารโคเวเลนต์
อะตอมไฮโดรเจน 2 อะตอมเคลื่อนที่เข้ากันจะเกิดแรงดึงดูดระหว่างอิเล็กตรอนของอะตอมหนึ่งกับโปรตอนในนิวเคลียสของอะตอมหนึ่งขณะเดียวกันก็มีแรงผลักระหว่างโปรตอนกับโปรตอนและอิเล็กตรอนกับอิเล็กตรอนของอะตอมทั้งสองด้วย แรงดึงดูดทำให้พลังงานศักย์ลดลงแต่แรงผลักทำให้พลังงานศักย์เพิ่มขึ้น ทำให้พลังงานศักย์รวมลดลงแล้วเพิ่มขึ้นตามระยะห่างระหว่างนิวเคลียสโดยมีผลรวมพลังงานศักย์ต่ำที่สุดเมื่อระยะทางระหว่างนิวเคลียสทั้งสองเท่ากับ 74 พิโกเมตร ถ้าอะตอมเคลื่อนที่เข้าใกล้กันมากกว่านี้และหากจะมีมากกว่าแรงดึงดูดซึ่งทำให้พลังงานศักย์รวมเพิ่มขึ้น

จากรูประยะห่างระหว่างนิวเคลียสที่ทำให้พลังงานศักย์รวมต่ำที่สุดเรียกว่าความยาวพันธะ ในทางปฏิบัติความยาวพันธะได้จากการศึกษาการเลี้ยวเบนของรังสีเอกซ์ เมื่อผ่านโครงผลึกของสารหรือจากการวิเคราะห์สเปกตรัมของโมเลกุลสาร ซึ่งพบว่าความยาวพันธะมีแนวโน้มเพิ่มขึ้นตามขนาดอะตอมคู่ร่วมพันธะและการใช้อิเล็กตรอนร่วมกันทำให้ความยาวพันธะโคเวเลนต์สั้นกว่าผลรวมของรัศมีอะตอมอิสระที่มาสร้างพันธะกันสำหรับอะตอมคู่ร่วมพันธะเดียวกันความยาวพันธะจะลดลงจากพันธะเดี่ยวพันธะคู่และพันธะสามตามลำดับอย่างไรก็ตามความยาวพันธะชนิดเดียวกันระหว่างอะตอมคู่เดียวกันอาจจะไม่เท่ากันในสารต่างชนิดกัน
ในการประมาณความยาวพันธะระหว่างอะตอมคู่หนึ่ง โดยทั่วไปนิยมใช้ความยาวพันธะเฉลี่ย การศึกษาความยาวพันธะของโมเลกุลโคเวเลนต์นำไปสู่การอธิบายการเกิดพันธะในโมเลกุลของสารโคเวเลนต์บางชนิดที่สามารถเขียนโครงสร้างลิวอิสตามกฎออกเตตได้มากกว่า 1 โครงสร้างเช่นโมเลกุลโอโซนมีโครงสร้างลิวอิส 2 โครงสร้างซึ่งประกอบด้วยพันธะเดี่ยวและพันธะคู่ระหว่างออกซิเจนที่ควรมีค่าความยาวพันธะไม่เท่ากัน แต่จากการศึกษาพบว่าความยาวพันธะระหว่างออกซิเจนมีค่าเท่ากับ 128 พิโกเมตรเพียงค่าเดียว ซึ่งเป็นค่าที่อยู่ระหว่างความยาวพันธะ O-O (148 พิโกเมตร) และพันธะ O=O (121 พิโกเมตร) แสดงว่าพันธะทั้งสองในโมเลกุลโอโซนเป็นพันธะชนิดเดียวกันที่อาจอธิบายได้โดยทฤษฎี เรโซแนนซ์ ว่าอิเล็กตรอนคู่ร่วมพันธะ 1 คู่เคลื่อนย้ายไปมาระหว่างอะตอมทั้ง 3 ทำให้เกิดโครงสร้างผสมระหว่าง 2 โครงสร้างการเคลื่อนย้ายตำแหน่งของอิเล็กตรอนคู่ร่วมพันธะในโมเลกุลที่เขียนโครงสร้างลิวอิสได้มากกว่าหนึ่งแบบเรียกว่า เรโซแนนซ์ และเรียกโครงสร้างลิวอิสแต่ละแบบว่า โครงสร้างเรโซแนนซ์ โดยแสดงการเกิดเรโซแนนซ์ระหว่างโครงสร้างด้วยลูกศร 2 หัวและเรียกโครงสร้างผสมของโครงสร้างเรโซแนนซ์ทุกโครงสร้างว่าโครงสร้างเรโซแนนซ์ผสม ดังรูป

นอกจากความยาวพันธะแล้ว กราฟที่แสดงการเปลี่ยนแปลงพลังงานในการเกิดโมเลกุลแก๊สไฮโดรเจนและแสดงให้เห็นว่าโมเลกุลแก๊สไฮโดรเจนมีพลังงานต่ำกว่าอะตอมไฮโดรเจน 436 กิโลจูลต่อโมล หมายความว่าการทำให้โมเลกุลแก๊สไฮโดรเจน 1 โมเลกุลแยกออกเป็นอะตอมไฮโดรเจน 2 อะตอมต้องใช้พลังงานอย่างน้อย 436 กิโลจูลต่อโมลในการสลายพันธะ ระหว่างอะตอมไฮโดรเจนดังสมการ
H2(g) + 436 kJ/mol ---> 2H(g)
ในทางกลับกัน อะตอมไฮโดรเจน 2 อะตอมสร้างพันธะระหว่างกันเกิดเป็นโมเลกุลแก๊สไฮโดรเจน 1 โมเลกุลจะคายพลังงาน 436 กิโลจูลต่อโมล ดังนี้
2H(g) ---> H2(g) + 436 kJ/mol
พลังงานปริมาณน้อยที่สุดที่ใช้ในการสลายพันธะระหว่างอะตอมคู่ร่วมพันธะในโมเลกุลในสถานะแก๊สให้เป็นอะตอมเดี่ยวในสถานะแก๊สเรียกว่าพลังงานพันธะซึ่งส่วนใหญ่ใช้หน่วยเป็นกิโลจูลต่อโมล
การประมาณพลังงานพันธะระหว่างอะตอมคู่หนึ่งโดยทั่วไปนิยมใช้พลังงานพันธะเฉลี่ยดังตาราง
จากตาราง จะเห็นว่าพันธะระหว่างคาร์บอนมีทั้งพันธะเดี่ยวพันธะคู่และพันธะสามซึ่งมีค่าพลังงานพันธะเป็น 346 614 และ 839 กิโลจูลต่อโมลตามลำดับ แสดงว่าพันธะสามแข็งแรงกว่าพันธะคู่และพันธะคู่แข็งแรงกว่าพันๆเดี่ยวและถ้าพิจารณาอะตอมคู่ร่วมพันธะๆเดียวกันของแท้ที่มีค่าพลังงานน้อยจะมีความยาวพันธะมาก นอกจากอะตอมคู่ร่วมพันธะเดียวกันแล้วความสัมพันธ์นี้ยังสามารถใช้เปรียบเทียบพันธะของธาตุในหมู่เดียวกันได้อีกด้วย
ปฏิกิริยาเคมีที่เกี่ยวข้องกับกระบวนการสลายพันธะในสารตั้งต้นและการสร้างพันธะเกิดเป็นผลิตภัณฑ์โดยการสลายพันธะเป็นกระบวนการดูด (E1) พลังงานซึ่งมีค่าเป็นบวกและการสร้างพันธะจะมีค่าเป็นลบเป็นกระบวนการคายพลังงาน (E2) และพลังงานของปฏิกิริยา (เดลต้า H) คำนวณได้จากผลรวมของ
E1 และ E2 เดลต้า H = E1 + E2
ถ้าพลังงานที่ใช้สลายพันธะมีค่ามากกว่าพลังงานที่ใช้สร้างพันธะจะได้ เดลต้า H มีเครื่องหมายเป็นบวก แสดงว่าปฏิกิริยานั้นเป็นปฏิกิริยาดูดพลังงานในทางกลับกันถ้าพลังงานที่คายออกมาจากการสร้างสรรค์ๆมีค่ามากกว่าพลังงานที่ต้องใช้สลายพันธะ จะได้เดลต้า H มีเครื่องหมายเป็นลบ แสดงว่าปฏิกิริยานั้นเป็นปฏิกิริยาคายพลังงาน
3.3.4 รูปร่างโมเลกุลโคเวเลนต์
โมเลกุลโคเวเลนต์ที่ประกอบด้วยอะตอมมากกว่า 2 อะตอมนอกจากความยาวพันธะและพลังงานพันธะแล้วข้อมูลที่ใช้ในการอธิบายสมบัติของสารคือ รูปร่างโมเลกุล ในโมเลกุลของน้ำคาร์บอนไดออกไซด์แอมโมเนียและโบรอนไตรฟลูออไรด์มีรูปร่างเป็นโมเลกุลที่ต่างกันหรือไม่อย่างไรเนื่องจากโมเลกุลมีขนาดเล็กมากจึงไม่สามารถพิจารณารูปร่างโมเลกุลได้โดยตรงและสามารถศึกษาเกี่ยวกับรูปร่างโมเลกุลโดยการจำลองตำแหน่งของคู่อิเล็กตรอน ในการทดลอง ดังนี้
จากกิจกรรม ในตอนที่ 1 ลูกโป่งแต่ละลูกซึ่งมีปริมาตรเท่ากันเมื่อนำมาผูกข้อติดกันพบว่าลูกโป่งแต่ละรูปผัดกันเกิดการจับตัวเป็นรูปร่างต่างๆที่สมมาตรในที่มีลูกโป่งเป็นตัวแทนของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอะตอมกลางและอะตอมล้อมรอบซึ่งอิเล็กตรอนเหล่านี้จะผลักกันด้วยแรงกระทำระหว่างประจุชนิดเดียวกันทำให้ได้คิดค่าของพันธะอยู่ห่างกันมากที่สุดเกิดเป็นรูปร่างโมเลกุลในลักษณะเดียวกันกับการจัดตัวของลูกโป่ง และในกิจกรรมตอนที่ 2 ลูกโป่งต่างสีใช้แทนอิเล็กตรอนคู่ร่วมพันธะและอิเล็กตรอนคู่โดดเดี่ยวซึ่งรูปร่างโมเลกุลพิจารณาจากตำแหน่งของอะตอมทั้งหมดโดยไม่นำตำแหน่งของอิเล็กตรอนคู่โดดเดี่ยวมาพิจารณา การคาดคะเนรูปร่างโมเลกุลจากโครงสร้างลิวอิสโดยอาศัยการผลักกันของอิเล็กตรอนคู่ร่วมพันธะและอิเล็กตรอนคู่โดดเดี่ยวอาจใช้ทฤษฎีการผลักระหว่างคู่อิเล็กตรอนในวงเวเลนซ์ (VSEPR) โดยทฤษฎีนี้มีหลักการว่าอิเล็กตรอนคู่โดดเดี่ยวอยู่ใกล้นิวเคลียสมากกว่าอิเล็กตรอนคู่ร่วมพันธะดังนั้นรหัสระหว่างอิเล็กตรอนคู่โดดเดี่ยวด้วยกันจึงมีค่ามากกว่าแรงผลักระหว่างอิเล็กตรอนคู่ร่วมพันธะกับอิเล็กตรอนคู่โดดเดี่ยว และมากกว่าแรงผลักระหว่างอิเล็กตรอนคู่ร่วมพันธะด้วยกัน
จากผลการทดลองกิจกรรมการจับตัวของลูกโป่งกับรูปร่างโมเลกุลโคเวเลนต์สรุปรูปร่างโมเลกุลโคเวเลนต์ดังตาราง




3.3.5 สภาพขั้วของโมเลกุลโคเวเลนต์
สารโคเวเลนต์ที่เกิดจากอะตอมชนิดเดียวกันเช่นแก๊สไฮโดรเจนมีการกระจายของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอะตอมทั้งสองเท่ากันทั้งๆที่เกิดขึ้นในลักษณะเช่นนี้จะเรียกว่าพันธะโคเวเลนต์ไม่มีขั้วและสารโคเวเลนต์ที่เกิดจากอะตอมต่างชนิดกันและมีค่าอิเล็กโทรเนกาติวิตีแตกต่างกันจะมีการกระจายของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอะตอมไม่เท่ากันเช่นไฮโดรเจนคลอไรด์มีอิเล็กตรอนคู่ร่วมพันธะอยู่บริเวณอะตอมคลอรีนมากกว่าอะตอมไฮโดรเจนเพราะอะตอมคลอรีนมีค่าอิเล็กโทรเนกาติวิตีมากกว่าอะตอมไฮโดรเจนทำให้อะตอมของดีแสดงประจุไฟฟ้าค่อนข้างรถยนต์อะตอมไฮโดรเจนมีค่าอิเล็กโทรเนกาติวิตีน้อยกว่าแสดงประจุไฟฟ้าค่อนข้างบวก ที่เกิดขึ้นลักษณะนี้เรียกว่าพันธะโคเวเลนต์มีขั้ว การแสดงขั้วของพันธะอาจใช้สัญลักษณ์ เดลต้าบวก สำหรับอะตอมที่แสดงประจุไฟฟ้าค่อนข้างบวก และเดลต้าลบ สำหรับอะตอมที่แสดงประจุไฟฟ้าค่อนข้างลบหรืออาจใช้เครื่องหมายโดยให้หัวลูกศรหันชี้ไปในทิศของอะตอมที่แสดงประจุไฟฟ้าค่อนข้างลบส่วนท้ายลูกศร ที่มีลักษณะคล้ายเครื่องหมายบวกให้อยู่บริเวณอะตอมที่แสดงประจุไฟฟ้าค่อนข้างบวก

ของพันธะทำให้โมเลกุลอะตอมคู่ที่ประกอบด้วยธาตุชนิดเดียวกันเป็นโมเลกุลไม่มีขั้วโมเลกุลอะตอมคู่ที่ประกอบด้วยธาตุต่างชนิดกันเป็นโมเลกุลมีขั้วและโมเลกุลโคเวเลนต์ที่ประกอบด้วยอะตอมมากกว่า 2 อะตอม และพันธะระหว่างครูอะตอมเป็นพันธะมีขั้วจะเป็นโมเลกุลมีขั้วหรือไม่อย่างไร สภาพขั้วของโมเลกุลที่ประกอบด้วยอะตอมมากกว่า 2 อะตอมพิจารณาจากการรวมสภาพขั้วของพันธะแบบเวกเตอร์ ซึ่งถ้าเวกเตอร์ หักหลังกันหมดจะทำให้โมเลกุลไม่มีขั้วแต่ถ้าเวกเตอร์แทนละกันไม่หมดโมเลกุลจะเป็นโมเลกุลที่มีขั้ว
โมเลกุลที่อะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว และอะตอมล้อมรอบเหมือนกันทุกอะตอมเป็นโมเลกุลไม่มีขั้วถึงแม้ว่าพันธะภายในโมเลกุลจะเป็นพันธะที่มีขั้วแต่เนื่องจากรูปร่างโมเลกุล
สำหรับโมเลกุลที่อะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวหรือมีอะตอมล้อมรอบเป็นธาตุต่างชนิดกันส่วนใหญ่เป็นโมเลกุลมีขั้วเนื่องจากเวกเตอร์สภาพขั้วของพันธะหักล้างกันไม่หมด
โมเลกุลอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวส่วนใหญ่เป็นโมเลกุลแบบมีขั้วและมีบางชนิดอาจเป็นโมเลกุลไม่มีขั้วเนื่องจากมีรูปร่างโมเลกุลแบบสี่เหลี่ยมแบนราบทำให้เวกเตอร์สภาพขั้วหักล้างกันหมดโมเลกุลอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวส่วนใหญ่เป็นโมเลกุลแบบมีขั้วและมีบางชนิดอาจเป็นโมเลกุลไม่มีขั้วเนื่องจากมีรูปร่างโมเลกุลแบบสี่เหลี่ยมแบนราบทำให้เวกเตอร์สภาพขั้วหักล้างกันหมด
3.3.6 แรงยึดเหนี่ยวระหว่างโมเลกุลและสมบัติของสารโคเวเลนต์
ที่อุณหภูมิห้องสารโคเวเลนต์แต่ละชนิดอันอยู่ในสถานะที่แตกต่างกันทั้งนี้ขึ้นอยู่กับแรงยึดเหนี่ยวระหว่างโมเลกุลหรือแรงแวนเดอร์วาลส์ โดยในสถานะของแข็งโมเลกุลอยู่ชิดกันจนไม่สามารถเคลื่อนที่ได้และมีแรงยึดเหนี่ยวระหว่างโมเลกุลมากในสถานะของเหลวโมเลกุลสามารถเคลื่อนที่ได้แต่ยังคงอยู่ชิดติดกันและมีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยกว่าในของแข็งส่วนในสถานะแก๊สโมเลกุลอยู่ห่างกันสามารถเคลื่อนที่ได้อย่างอิสระและมีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยมากจนถือว่าไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุลดังนั้นการเปลี่ยนแปลงสถานะของสารจากของแข็งไปเป็นของเหลว หรือของเหลวไปเป็นแก๊สซึ่งเกี่ยวข้องกับการทำลายงานยึดเหนี่ยวระหว่างโมเลกุลโดยไม่มีการทำลายพันธะโคเวเลนต์ ซึ่งแรงยึดเหนี่ยวระหว่างโมเลกุลมีค่าพลังงานน้อยกว่าพันธะโคเวเลนต์มากสามารถทำลายได้ด้วยการให้พลังงานความร้อนแก้สารจนกระทั่งโมเลกุลของสารมีพลังงานจลน์สูงพอที่จะเกิดการเปลี่ยนแปลงสถานะได้ดังนั้นสารแต่ละชนิดซึ่งมีแรงยึดเหนี่ยวระหว่างโมเลกุลที่แตกต่างกันจะมีจุดหลอมเหลวและจุดเดือดที่ต่างกันด้วย
นอกจากจุดหลอมเหลวของสารที่จะเกี่ยวข้องกับแรงยึดเหนี่ยวระหว่างโมเลกุลแล้วยังขึ้นอยู่กับการจัดเรียงโมเลกุลในของแข็งทำให้แนวโน้มของจุดหลอมเหลวอาจไม่สอดคล้องกับแรงยึดเหนี่ยวระหว่างโมเลกุลโดยตรง
แรงยึดเหนี่ยวระหว่างโมเลกุลเกี่ยวข้องกับขนาดของโมเลกุลและสภาพขั้วของโมเลกุลซึ่งแรงยึดเหนี่ยวระหว่างโมเลกุลมีหลายชนิดและมีชื่อเรียกที่ต่างกันซึ่งในที่นี้จะกล่าวถึง 3 ชนิดที่สำคัญดังนี้
1.และแพร่กระจายลอนดอน แรงแพร่กระจายลอนดอน เป็นแรงยึดเหนี่ยวระหว่างโมเลกุลไม่มีขั้วหรืออะตอมแก๊สมีสกุลซึ่งเป็นแรงอย่างอ่อนๆที่เกิดขึ้นจากการกระจายของอิเล็กตรอนในอะตอมขณะใดขณะหนึ่งซึ่งอาจไม่เท่ากันจึงทำให้สภาพขั้วชั่วขณะ แล้วเหนี่ยวนำให้โมเลกุลที่อยู่ติดกันเกิดขั้วตรงข้ามและมีแรงดึงดูดชั่วขณะ โดยแรงแผ่กระจายนี้เพิ่มขึ้นตามขนาดของโมเลกุลเนื่องจากโมเลกุลขนาดใหญ่สามารถเกิดสภาพขั้วชั่วขณะได้มากกว่า
2.แรงระหว่างขั้วสำหรับโมเลกุลมีขั้วนอกจากจะมีแรงแผ่กระจายลอนดอนแล้ว ยังมีแรงดึงดูดที่เกิดจากสภาพของขั้วโมเลกุลด้วยโมเลกุลที่อยู่ใกล้กันจะหันส่วนของโมเลกุลที่มีขั้วตรงข้ามกันเข้าหากันเกิดเป็นแรงดึงดูดทางไฟฟ้าจากสภาพขั้วนี้โดยทั่วไปในระหว่างขั้วเพิ่มขึ้นตามสภาพขั้วของโมเลกุลที่มีขนาดใกล้เคียงกัน
3.พันธะไฮโดรเจนเมื่อพิจารณาจุดเดือดของสารประกอบไฮโดรเจนกับธาตุหมู่ VIIA จะเห็นว่า HF มีจุดเดือดสูงกว่าสารประกอบอื่นทั้งที่มีขนาดโมเลกุลเล็กที่สุดซึ่งไม่เป็นไปตามแนวโน้มของขนาดโมเลกุลดังที่ได้กล่าวมาแล้วข้างต้นแสดงว่า HF มีแรงดึงดูดระหว่างโมเลกุลมากกว่าสารประกอบของไฮโดรเจนกับธาตุหมู่ VIIA อื่นๆ ทั้งนี้เพราะผลต่างของค่าอิเล็กโทรเนกาติวิตีระหว่างไฮโดรเจนกับฟลูออรีนมีค่ามากทำให้กลุ่มหมอกอิเล็กตรอนอยู่ทางด้านอะตอมฟลูออรีนที่มีขนาดเล็กอย่างหนาแน่นอะตอมฟลูออรีนและไฮโดรเจนมีสภาพขั้วสูงกว่าในกรณีที่ HCl HBr และ HI มาก ทำให้มีแรงดึงดูดระหว่างโมเลกุลมากด้วยแรงดึงดูดระหว่างโมเลกุลที่เกิดขึ้นจากอะตอมไฮโดรเจนของโมเลกุลหนึ่งกับอิเล็กตรอนคู่โดดเดี่ยวบนอะตอมของธาตุที่มีขนาดเล็กและมีอิเล็กโทรเนกาติวิตีสูงของอีโมเลกุลหนึ่งเรียกแรงดึงดูดนี้ว่า พันธะไฮโดรเจน
3.4 พันธะโลหะ
โลหะบางชนิดเส้นทองแดง เหล็กอะลูมิเนียมมีสมบัติบางประการคล้ายกับแสดงว่าสารเหล่านี้มีการยึดเหนี่ยวกันระหว่างอนุภาคที่เหมือนกันและอะตอมธาตุโลหะสร้างพันธะเคมีระหว่างกันอย่างไรเหมือนหรือต่างกัน จากพันธะไอออนิกและโคเวเลนต์หรือไม่
3.4.1 การเกิดพันธะโลหะ
จากที่ทราบแล้วว่าโลหะส่วนใหญ่มีสถานะเป็นของแข็งมีจุดหลอมเหลวและจุดเดือดสูงผิวมันวาวสามารถนำไฟฟ้าและความร้อนได้ดีจะสมบัติดังกล่าวจะเห็นว่าโลหะมีสมบัติบางประการของสารประกอบไอออนิกและมีสมบัติบางประการที่แตกต่างจากสารประกอบไอออนิกเช่นการนำไฟฟ้าและการนำความร้อนได้ดีในสถานะของแข็งผิวมันวาวและสมบัติส่วนใหญ่ต่างจากพันธะโคเวเลนต์ซึ่งแสดงว่าโลหะน่าจะยึดเหนี่ยวกันด้วยพันธะที่แตกต่างจากพันธะไอออนิกและพันธะโคเวเลนต์การที่อะตอมของโลหะมีค่าพลังงานไอออไนเซชันต่างการยึดเหนี่ยวระหว่างวาเลนอิเล็กตรอนกับโปรตอนในนิวเคลียสจึงน้อยให้เวเลนซ์อิเล็กตรอนของแต่ละอะตอมสามารถเคลื่อนที่ได้อย่างอิสระไปทั่วทั้งชิ้นโลหะและเกิดการยึดเหนี่ยวกับโปรตอนในนิวเคลียสทุกทิศทุกทางการยึดเหนี่ยวนี้เรียกว่าพันธะโลหะการเกิดพันธะโลหะแสดงได้ด้วยแบบจำลองทะเลอิเล็กตรอน
3.4.2 สมบัติของโลหะ
1.โลหะมีจุดหลอมเหลวและจุดเดือดสูง
2.โลหะมีผิวมันวาวและสามารถสะท้อนแสงได้
3.โลหะนำไฟฟ้าและความร้อนได้ดี นอกจากนี้โลหะยังสามารถตีให้ออกเป็นแผ่นและดึงให้เป็นเส้นด้าย
3.5 การใช้ประโยชน์ของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ
จากการที่สารประกอบไอออนิกสารโคเวเลนต์และโลหะมีสมบัติเฉพาะตัวมาว่าการที่ต่างกันจึงสามารถนำมาใช้ประโยชน์ในด้านต่างๆได้ตามความเหมาะสม เช่น
- แอมโมเนียมคลอไรด์และซิงค์คลอไรด์ เป็นสารประกอบไอออนิกที่สามารถนำไฟฟ้าได้จากการแตกตัวเป็นไอออนเมื่อละลายน้ำจึงนำไปใช้เป็นสารอิเล็กโทรไลต์ในถ่านไฟฉาย
- พอลิไวนิลคลอไรด์หรือ PVC เป็นสารโคเวเลนต์ที่ไม่สามารถนำไฟฟ้าได้จึงเป็นฉนวนไฟฟ้าที่หุ้มสายไฟฟ้า
- ซิลิกอนคาร์ไบด์ เป็นสารโคเวเลนต์โครงร่างตาข่ายที่มีจุดหลอมเหลวสูงและมีความแข็งแรงมากจึงนำไปใช้ทำเครื่องบด
- ทองแดงและอะลูมิเนียม เป็นโลหะที่นําไฟฟ้าได้ดีจึงนำไปใช้เป็นตัวนำไฟฟ้าอลูมิเนียมและเหล็กเป็นโลหะที่นําความร้อนได้ดีจึงนำไปทำภาชนะสำหรับประกอบอาหาร เช่น หม้อ กะทะ
ที่มา : หนังสือเรียนรายวิชาเพิ่มเติมวิทยาศาสตร์ เคมี เล่ม 1